构造原理在电子排布中有什么重要作用?它是如何决定电子的能级顺序的?
参考资料
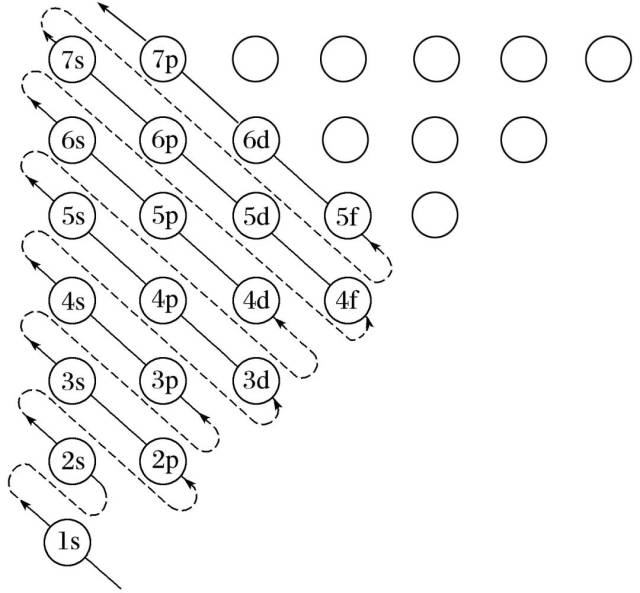
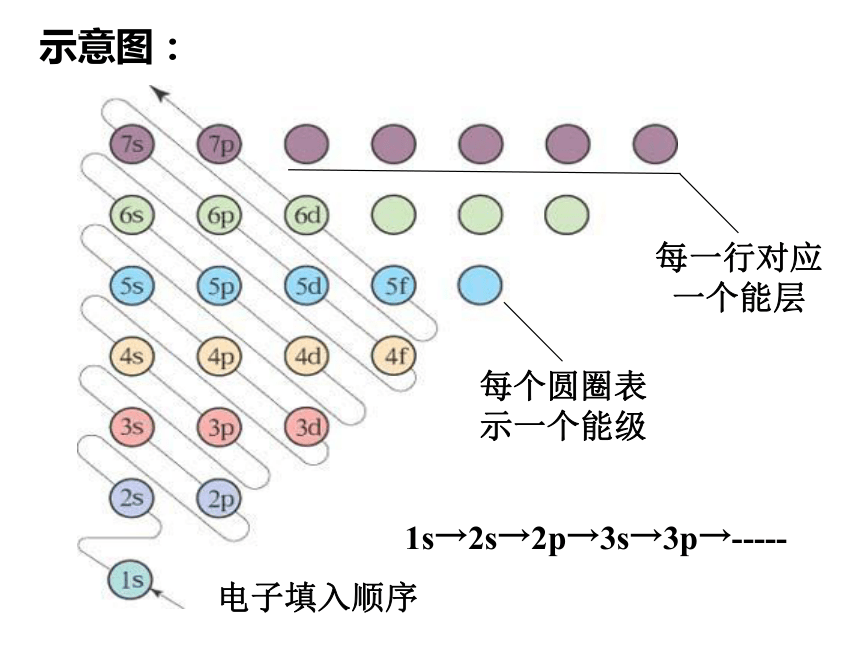
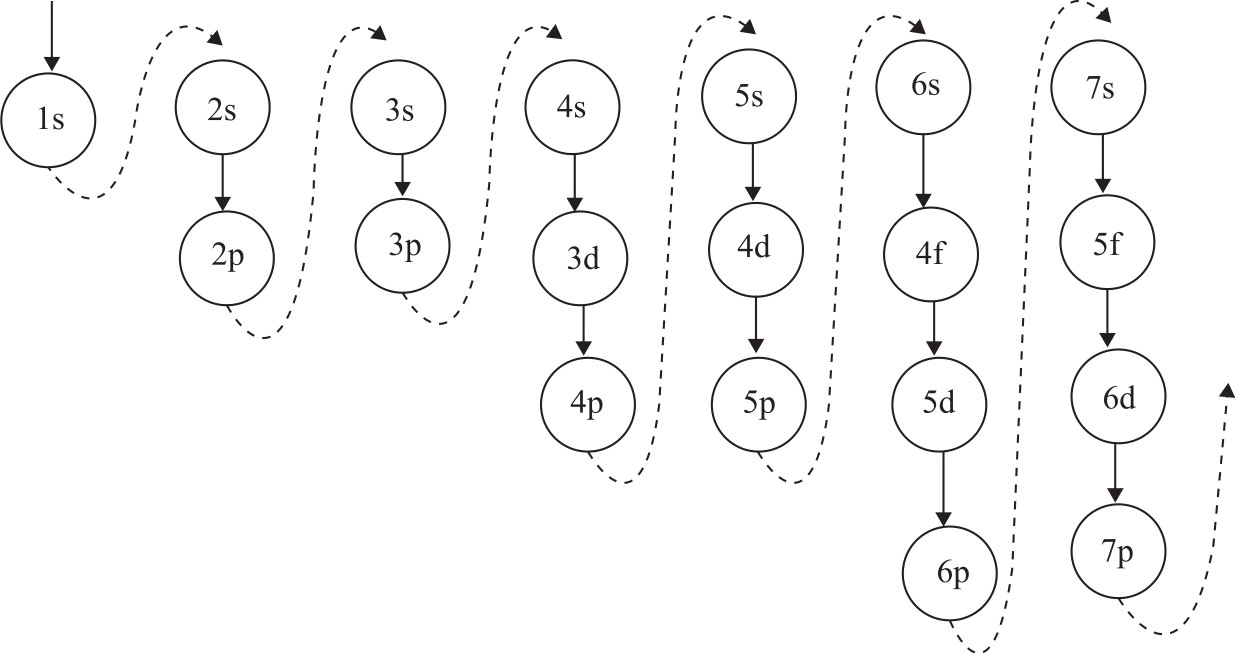
Moonshot回答
构造原理在电子排布中起着至关重要的作用,它决定了电子在原子轨道中的填充顺序。根据构造原理,电子会首先填充最低能量的轨道,然后依次填充更高能量的轨道。这一原理解释了电子在不同能级中的分布,并且是理解原子结构和化学性质的基础。
构造原理指出,从氢开始,随着核电荷数的增加,新增电子会按照特定的顺序填充能级。这个顺序通常遵循以下规则:1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f、5d、6p、7s、5f、6d、7p。这个顺序决定了电子的能级顺序,并且与原子的电子亲和能、电离能和化学键的形成有关。
构造原理还与泡利不相容原理和洪特规则一起,共同决定了电子在原子轨道中的排布。泡利不相容原理指出,一个原子轨道中最多只能有两个电子,并且这两个电子的自旋方向必须相反。洪特规则则说明,在填充具有相同能量的轨道时,电子会尽可能单独占据一个轨道,并且自旋方向相同,以达到较低的总能量状态。
通过构造原理,我们可以预测原子的电子排布,进而了解原子的化学性质和它们如何与其他原子相互作用。例如,铜(Cu)的电子排布是1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ 3d⁹,这表明铜有一个未成对的3d电子,使其具有特定的化学性质和催化活性。
总的来说,构造原理是理解电子在原子中如何排布的关键,它决定了电子的能级顺序,并且对化学元素的性质和它们之间的相互作用有着深远的影响。