铜的电子排布为什幺会优先填充为3d10 4s1而非3d9 4s2?这背后的能量稳定性原理是什么?
参考资料


Moonshot回答
铜的电子排布优先填充为3d10 4s1而非3d9 4s2,这背后的能量稳定性原理涉及到量子力学和原子物理学中的几个重要规则:最低能量原理、泡利不相容原理和洪特规则。
-
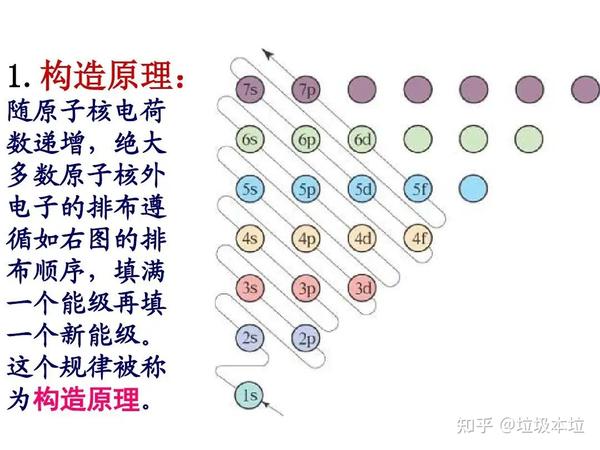
最低能量原理:电子会优先填充能量较低的轨道,以使整个原子系统的总能量最低。对于铜(Cu),其电子排布为 [Ar] 3d^10 4s^1。这种排布方式使得电子的总能量最低,因此更为稳定。
-
泡利不相容原理:一个原子轨道中最多只能有两个电子,并且这两个电子的自旋方向必须相反。在3d轨道中填满10个电子,符合这一原理。
-
洪特规则:在等能量的轨道上,电子会尽可能分占不同的轨道,并且自旋方向相同。对于铜来说,3d轨道的电子填充为3d^10,满足了洪特规则,因为所有5个3d轨道各有一个电子,且自旋方向相同。
此外,虽然3d^9 4s^2的排布在直观上看似更稳定,因为4s轨道的电子更靠近原子核,但3d^10的排布实际上更稳定,因为3d轨道的电子可以形成更强的键合,从而降低整个原子的能量。
从搜索结果中,我们可以看到铜原子的外层电子构型为[Ar]3d^10 4s^1,这种排布方式使得总极化能达到最低,体现出铜的高导电和良好的电化学性质。同时,铜离子的核外电子排布图也显示了铜离子的电子排布遵循上述原理。因此,铜的电子排布优先填充为3d^10 4s^1,是基于能量最低原理、泡利不相容原理和洪特规则的综合结果。