伽凡尼电池是如何通过连接不同的半电池产生电流的,连接过程中的电势差如何影响反应?
参考资料


参考资料



Moonshot回答
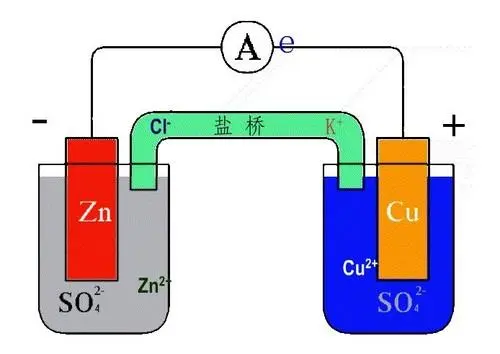
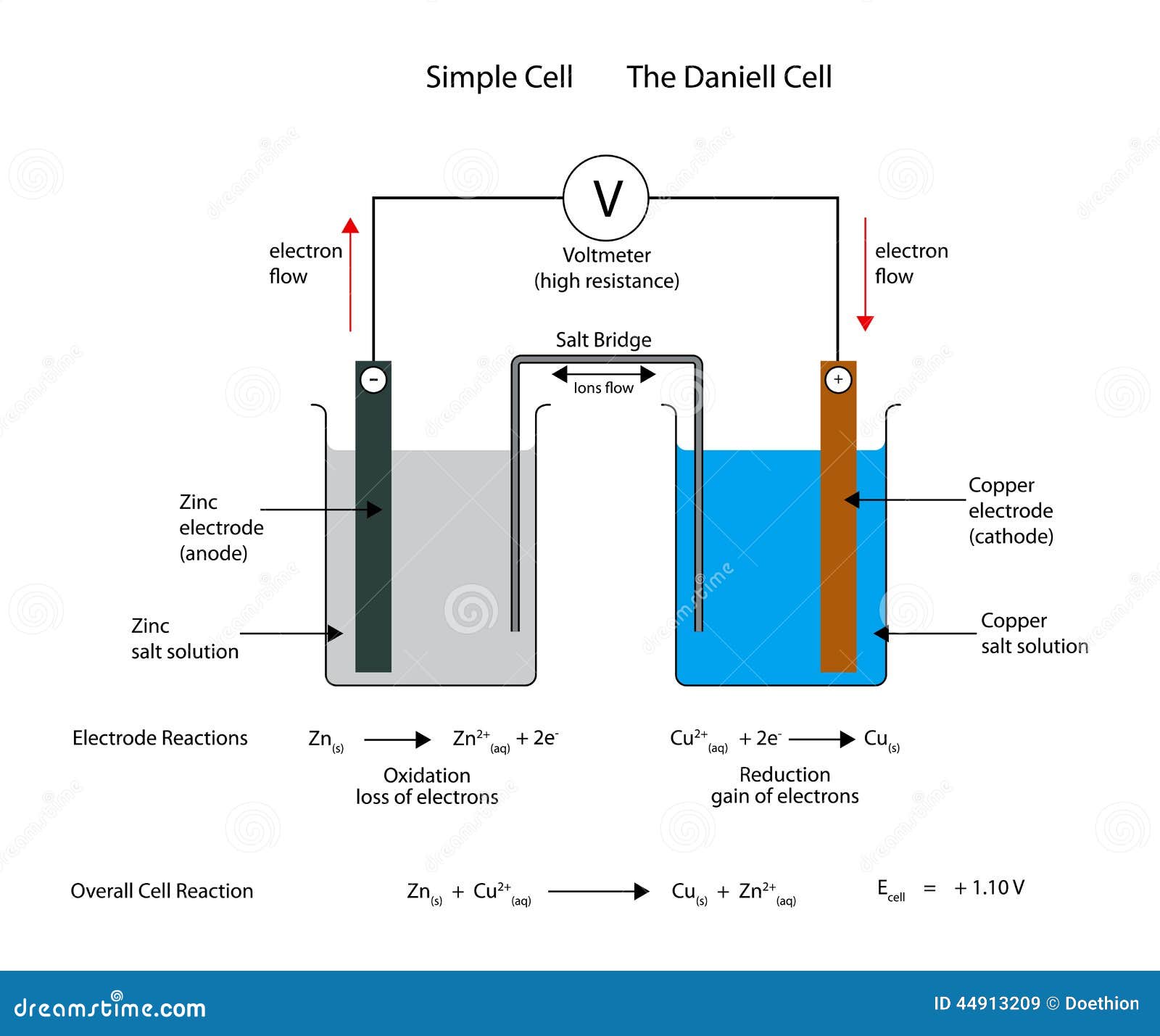
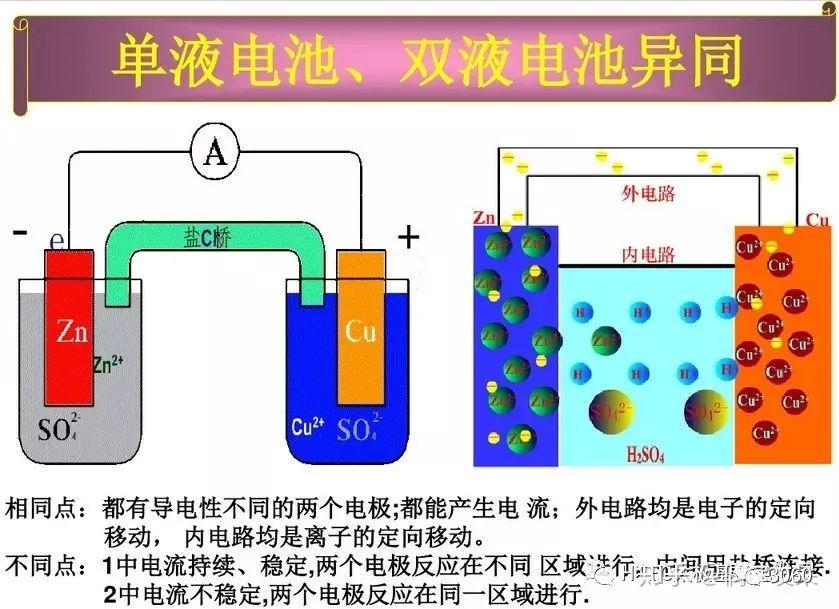
伽凡尼电池(Galvanic cell),又称伏打电池(Voltaic cell),是一种通过氧化还原反应将化学能转换为电能的电化学电池。它由两个半电池组成,每个半电池包含一种金属电极和一种电解质。当两种不同金属(例如锌和铜)连接时,它们之间会产生电势差,导致电子从一种金属流向另一种金属,从而产生电流。
电势差是伽凡尼电池工作的关键因素,它由两个半电池的标准电极电势之差决定。电势差越大,电池产生的电流就越大。在连接过程中,较活泼的金属(如锌)会失去电子(氧化),而较不活泼的金属(如铜)会获得电子(还原)。这种电子的流动形成了电流,可以驱动外部电路中的电子设备。
盐桥或多孔物质用于连接两个半电池,以允许离子在两个半电池之间移动,保持电荷平衡,同时防止两个半电池的电解质混合。这种设计确保了电池反应的持续进行。
总的来说,伽凡尼电池的工作原理基于不同金属之间的电势差,通过氧化还原反应产生电流。电势差的大小直接影响电池的性能和电流的产生。