什么是放射性碳定年法,它的基本原理是什么?
参考资料
Moonshot回答
放射性碳定年法,也称为碳-14定年法或放射性碳测年,是一种通过测量碳同位素C-14的放射性来测定含有有机物质的物品年代的方法。这种方法由美国芝加哥大学的威拉得·利比在1940年代发现,并因此获得了1960年的诺贝尔化学奖。
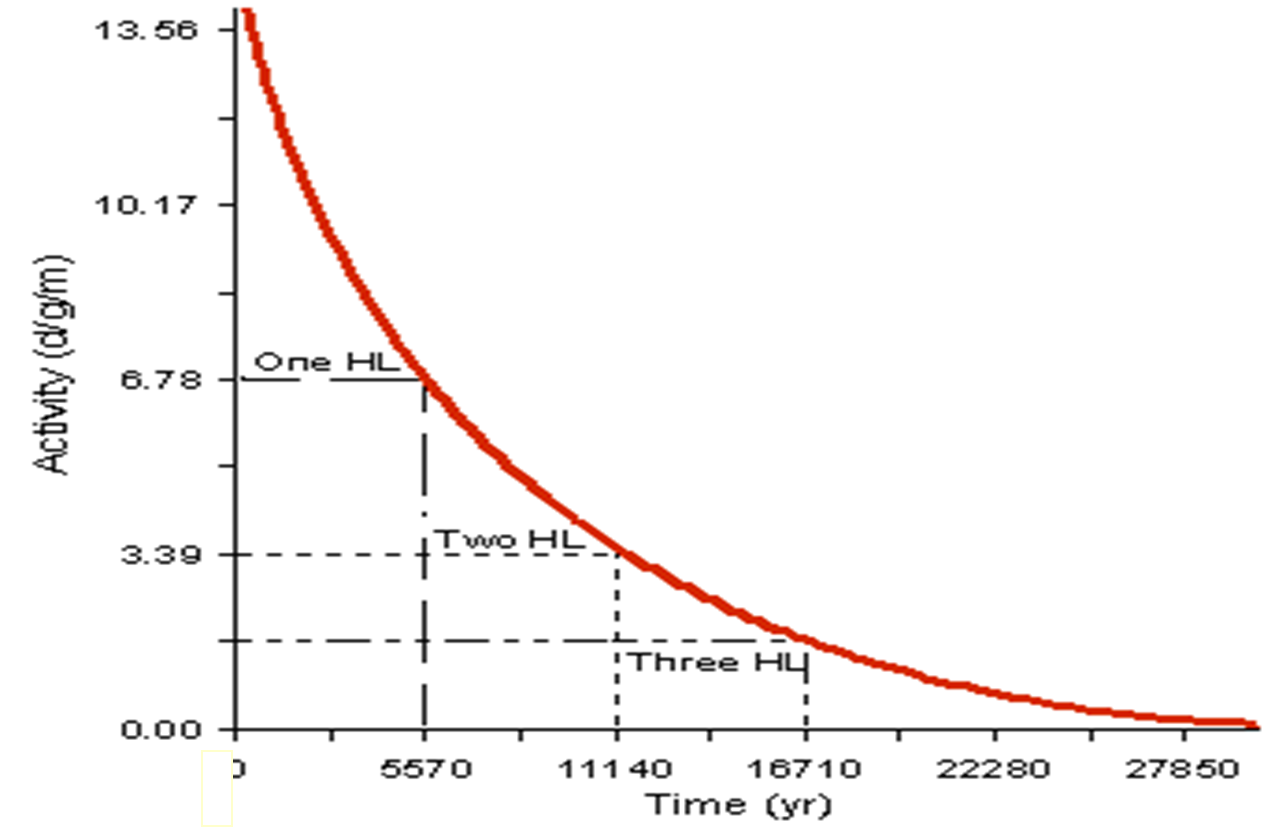
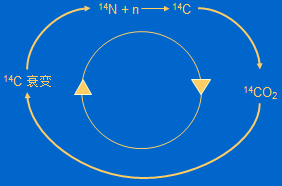
其基本原理是利用宇宙射线在大气中产生的放射性碳同位素C-14。生物体在存活时,会通过呼吸、进食等不断从外界摄入C-14,并与环境中的C-14与碳-12(C-12)比值达到平衡。当生物体死亡后,它不再摄入新的C-14,而体内的C-14会通过放射性衰变逐步减少。由于C-14的半衰期(即一个样本的一半衰变的时间周期)大约是5730年,通过测量死去动植物样本的C-14含量,例如一块木头或者一段骨头,就可以推算出动植物死亡的时间。样本越古老,可检测到的C-14含量就越少。
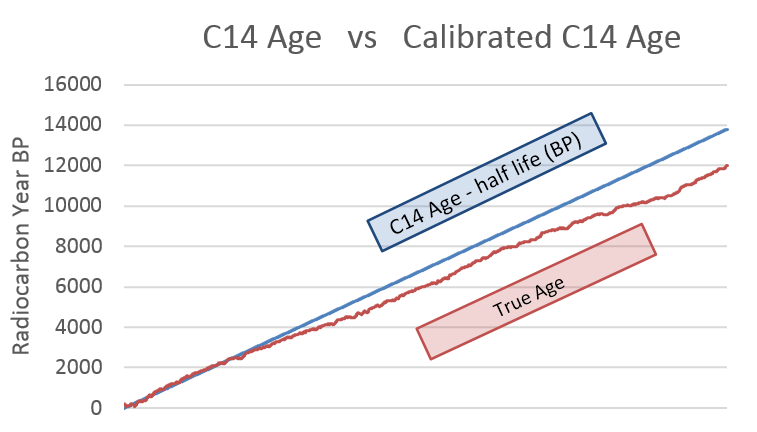
放射性碳定年法可以测定早至五万年前有机物质的年代,对于考古学来说,这是一个准确的定年法技术。不过,由于不同年代大气中C-14的比例会有变化,以及生物圈中C-14含量可能受到其他因素的影响(如海洋碳库效应、同位素分馏等),因此测量得到的C-14含量通常需要通过校准曲线进行校准后,才能得到准确的年代估计。
 图片来源:360图片搜索
图片来源:360图片搜索
通过这种方法,科学家能够对史前时代的大事件进行年代测定,对考古学有着深远的影响。